 |
| Begini Loh Mekanisme Kerja High Performance Liquid Chromatography (HPLC) |
Kromatografi adalah
suatu teknik pemisahan molekul berdasarkan perbedaan pola pergerakan
antara fase gerak dan fase diam untuk memisahkan komponen (berupa molekul) yang
berada pada larutan. Molekul yang terlarut dalam fase gerak, akan melewati
kolom yang merupakan fase diam. Molekul yang memiliki ikatan yang kuat
dengan kolom akan cenderung bergerak lebih lambat dibanding molekul yang
berikatan lemah. Dengan ini, berbagai macam tipe molekul dapat dipisahkan
berdasarkan pergerakan pada kolom.
Setelah komponen terelusi dari kolom, komponen
tersebut dapat dianalisis dengan menggunakan detektor atau dapat
dikumpulkan untuk analisis lebih lanjut. Beberapa alat-alat analitik dapat
digabungkan dengan metode pemisahan untuk analisis secara on-line (on-line
analysis) seperti: penggabungan kromatografi gas (gas chromatography)
dan kromatografi cair (liquid chromatography) dengan mass
spectrometry (GC-MS dan LC-MS), Fourier-transform infrared
spectroscopy (GC-FTIR), dan diode-array UV-VIS
(HPLC-UV-VIS).
Pengertian HPLC
Kromatografi cair berperforma
tinggi ((Inggris): high
performance liquid chromatography, HPLC) merupakan salah satu
teknik kromatografi untuk zat cair yang biasanya disertai
dengan tekanan tinggi. Seperti teknik kromatografi pada umumnya, HPLC
berupaya untuk memisahkan molekul berdasarkan perbedaan afinitasnya terhadap
zat padattertentu. Cairan yang akan dipisahkan merupakan fase cair dan zat
padatnya merupakan fase diam (stasioner). Teknik ini sangat berguna untuk
memisahkan beberapa senyawa sekaligus karana setiap senyawa mempunyai afinitas
selektif antara fase diam tertentu dan fase gerak tertentu. Dengan bantuan
detektor serta integrator kita akan mendapatkan kromatogram. Kromatorgram
memuat waktu tambat serta tinggi puncak suatu senyawa.
Prinsip Kerja HPLC
Kerja HPLC pada prinsipnya adalah pemisahan analit-analit berdasarkan
kepolarannya, alatnya terdiri dari kolom (sebagai fasa diam) dan larutan
tertentu sebagai fasa geraknya. Yang paling membedakan HPLC dengan kromatografi
lainnya adalah pada HPLC digunakan tekanan tinggi untuk mendorong fasa gerak.
Campuran analit akan terpisah berdasarkan kepolarannya, dan kecepatannya untuk
sampai ke detektor (waktu retensinya) akan berbeda, hal ini akan teramati pada
spektrum yang puncak-puncaknya terpisah.
Urutan skala polaritas :
golongan fluorocarbon < golongan hidrokarbon < senyawa terhalogenasi <
golongan eter < golongan ester < golongan keton < golongan alkohol
< golongan asam.
HPLC dapat menganalisa secara kualitatif dan kuantitatif. Pada proses
kualitatif cara yang paling umum untuk mengidentifikasi adalah dengan melihat
Retention time (RT). Peak yang mempunyai
RT yang sama dengan standard umumnya adalah sebagai peak milik analat. Selain
melihat RT hal lain yang perlu dilihat adalah spektrum 3D dari signal
kromatogram. Zat yang sama akan mempunyai spektrum 3D yang juga sama. Sehingga
jika spektrum 3D antara dua zat berbeda, maka kedua zat tersebut juga
dipastikan adalah zat yang berlainan, meskipun memiliki RT yang sama.
Kemudian melalui analisa
kuantitatif dapat diketahui kadar komponen yang dianalisis di dalam
sampel. Yang berperan dalam proses separasi pada system HPLC adalah
kolom. Ada kolom yang digunakan untuk beberapa jenis analisa, misalnya kolom
C18 yang dapat digunakan untuk analisa carotenoid, protein, lovastatin, dan
sebagainya. Namun ada juga kolom yang khusus dibuat untuk tujuan analisa tertentu,
seperti kolom Zorbax carbohydrat (Agilent) yang khusus digunakan untuk analisa
karbohidrat (mono-, di-, polysakarida). Keberhasilan proses separasi sangat
dipengaruhi oleh pemilihan jenis kolom dan juga fasa mobil.
Setelah komponen dalam
sample berhasil dipisahkan, tahap selanjutnya adalah proses identifikasi. Hasil
analisa HPLC diperoleh dalam bentuk signal kromatogram. Dalam kromatogram akan
terdapat peak-peak yang menggambarkan banyaknya jenis komponen dalam sample.
Sample yang mengandung
banyak komponen didalamnya akan mempunyai kromatogram dengan banyak peak. Bahkan tak jarang antar peak
saling bertumpuk (overlap). Hal ini akan menyulitkan dalam identifikasi dan
perhitungan konsentrasi. Oleh karena itu biasanya untuk sample jenis ini
dilakukan tahapan preparasi sample yang lebih rumit agar sample yang siap
diinjeksikan ke HPLC sudah cukup bersih dari impuritis. Sample farmasi biasanya
jauh lebih mudah karena sedikit mengandung komponen selain zat aktif. Sample
ini umumnya hanya melalui proses pelarutan saja.
PREPARASI SAMPEL
Sampel harus
dalam bentuk larutan. Untuk skala
analisis sampel dalam μL, konsentrasi sampel yang diinjeksikan tidak boleh
terlalu pekat karena dapat menyumbat kolom. Konsentrasi maksimal adalah sekitar
40 ppm.
PREPARASI FASA GERAK
Fasa gerak (eluen) yang digunakan harus dalam
kualitas p.a ataupun grade HPLC. Untuk air, digunakan akuabidest.
Sebelum digunakan, eluen harus disaring dengan
millipore kemudian diawagaskan (didigest) dengan sonikator sekitar 30
menit untuk menghilangkan udara terlarut.
Eluen harus
dimasukkan ke dalam tabung eluen sebelum alat dinyalakan, untuk menghindari
adanya gelembung pada selang penghubung.
Tabung eluen
yang sudah diisi harus diberi label sesuai dengan eluen yang digunakan.
PENYALAAN ALAT
• Sebelum alat dinyalakan, pastikan
dalam slang penghubung antara tabung eluen dengan pompa tidak terdapat
gelembung udara. Jika terdapat gelembung, buka penutup pompa kemudian buka
katup slang di ujung pompa dan sedot secepatnya gelembung tersebut dari slang
dengan alat penyedot gelembung yang tersedia kemudian tutup katup dan tutup
pompa kembali seperti semula.
• Hubungkan kabel alat ke sumber listrik
(saklar).
• Nyalakan tombol paling bawah alat HPLC
(tombol detektor).
• Nyalakan tombol tengah HPLC (kolom)
• Nyalakan tombol paling atas dari HPLC (pompa)
• Nyalakan tombol power CPU kemudian tombol power pada
monitor.
MEMBUKA
WINDOWS NT DAN AGILENT CHEMSTATION
• Setelah alat dan komputer menyala, pada layar komputer akan
muncul tampilan :
Windows NT
workstation version 4.00
Windows NT
workstation version 4.00(VGA mode)
PENYETABILAN ALAT SEBELUM INJEKSI
Sebelum
injeksi, alat yang baru saja dinyalakan harus distabilkan terlebih dahulu untuk
menjaga alat tersebut agar tetap awet, selain itu penyetabilan juga dimaksudkan
agar alat benar-benar siap injeksi sehingga kromatogram yang dihasilkan akan
bagus.
Untuk
menstabilkan alat, setelah masuk ke menu Online Agilent Chemstation, klik menu Run
Control. Kemudian :
• Klik pada gambar
pompa, klik control, klik on.
• Klik menu Instrument,
klik pada set up pump
>set
gradient fasa gerak
>set laju
alir
>set
waktu run dan post run
catatan :
dalam masa penyetabilan, setting laju alir cukup sekitar 0,1 uL/menit untuk
menghemat eluen.
• Klik pada kolom,
klik control, klik on.
• Klik gambar
DAD signals,klik control, klik on (pada UV atau Visible),
tergantung sample yang akan diinjeksikan.
• Klik menu Instrument,
klik set up colomn untuk mengatur kondisi kolom yang diinginkan.
• Klik menu Instrument,
klik Set Up DAD Signals untuk mengatur panjang gelombang detektor yang
diinginkan. Masukkan panjang gelombang pilihan disertai dengan tanda X.
• Biarkan
alat running dalam laju alir sekitar 0,1 uL/menit selama kurang lebih 45-60
menit untuk menstabilkan.
• Setelah
waktu tersebut, naikkan perlahan laju alir sampai laju alir yang diinginkan
(jangan langsung pada laju alir yang diinginkan) INGAT ! Naikkan
Perlahan....Agar tekanan pompa stabil...!
PERSIAPAN INJEKSI
INGAT.....:
TANDA MERAH = ALAT TIDAK SIAP
TANDA BIRU =
ALAT SEDANG RUNNING
TANDA HIJAU
= ALAT SIAP DIINJEKSI
• Nyalakan
detektor DAD dan kolom (seperti tadi)
• Perbesar
tampilan kromatogram di layar agar terlihat jelas
• Perhatikan kromatogram sampai
terbentuk baseline. Untuk mendekatkan line dengan jangkauan mata, tekan ADJUST,
untuk membuat baseline pada skala nol tekan BALANCE.
• Setelah baseline yang diinginkan
terbentuk, klik menu RUNCONTROL, klik SAMPLE INFO untuk
memasukkan data file-folder berikut keterangan sampel.
• Lihat tanda warna, jika sudah hijau
(READY) berarti siap injeksi.
• Sebaiknya kolom dicuci dulu dengan
cara menginjeksikan fasa gerak utama ke kolom. Begitu pula setiap setelah injek
satu sampel dan akan ganti dengan sampel lain, kolom harus dicuci dahulu
(sekitar 20 menit), pencucian masukkan ke dalam file CUCI.
CARA INJEKSI
• Ambil alat injek (syringe).
• Bilas syringe dengan zat yang sama
dengan fasa gerak utama (misalnya metanol)
• Kemudian bilas syringe dengan sampel
• Isi syringe dengan sampel, INGAT dalam
syringe yang sudah diisi tersebut tidak boleh ada ruang kosong oleh udara yang
terperangkap atau gelembung udara
• Volume injeksi maksimum adalah 20 uL
karena pada injektor standar terpasang loop 20 uL
• Masukkan jarum syringe ke injektor, buka injektor (load,
putar ke atas), injek cepat, tutup injektor (inject, putar ke bawah), baru
tarik jarum syringe dari injektor. Di layar segera akan ada tanda biru...Run in
progress data aquasition.........
• Setelah waktu running yang diinginkan habis, tekan tombol
F8 untuk menghentikan runing. Maka komputer akan segera menghitung tinggi
puncak-puncak yang keluar berikut luas puncaknya. Pada proses ini di layar akan
muncul tampilan biru dengan tulisan...”Run
in Progress Data Analysis”.
• Setelah di layar muncul kembali tampilan “Ready” (hijau),
maka pekerjaan selanjutnya dapat dilakukan. Untuk menginjeksikan kembali sampel
lain sebaiknya kolom dicuci terlebih dahulu. Masukkan running cuci kolom ke
dalam file cuci.
PRINT OUT
KROMATOGRAM
• Untuk melihat hasil analisis yang telah dilakukan komputer
terhadap sampel yang telah kita injeksikan, klik menu VIEW, Klik DATA
ANALYSIS.
• Kemudian Klik menu FILE dan
klik LOAD SIGNALS untuk memilih file mana yang akan dibuka beserta
panjang gelombang deteksi yang diinginkan. Segera akan keluar tampilan
kromatogram yang dipanggil.
• Untuk menampilkan waktu retensi
setiap puncak pada kromatogram yang dipanggil tersebut, Klik menu INTEGRATION
lalu klik INTEGRATE. Maka segera akan muncul nilai retensi dari
setiap puncak. Karena detektor yang ada yaitu DAD (Diode Arays Detector) sangat
sensitif, maka setiap puncak yang muncul, sekecil apapun akan dapat
terintegrasi sehingga puncak-puncak ini harus dihapus retensinya, artinya yang
kita tampilkan waktu retensinya hanya puncak-puncak yang besar dan yang kita
perlukan saja. Untuk keperluan tersebut, klik menu FILE, klik DELETE
PEAK sampai muncul tanda X merah. Atau dapat langsung klik di menu X
merah yang biasanya ada di layar. Untuk menghapusnya, klik dengan X merah
tersebut di tempat-tempat yang waktu retensinya tidak ingin ditampilkan.
• Untuk
mendapatkan print out kromatogram, Klik menu REPORT, klik SPECIFY
REPORT untuk mengatur tampilan kromatogram yang diinginkan. Setelah siap,
klik PRINT REPORT lalu tunggu sebentar sampai komputer menampilkan print
previewnya. Kemudian klik pada icons PRINT yang ada di bawah print
preview kromatogram.
• Untuk
kembali ke RUN CONTROL (misal akan injek baru), klik menu VIEW,
klik METHOD AND RUN CONTROL.
Pilih menu yang pertama (Windows
NT workstation version 4.00) secepatnya, kemudian tekan ENTER.
• Kemudian akan muncul menu Begin
Log On, tekan Ctrl-Alt-Del.
• Setelah itu akan muncul menu PassWord,
pada password ini tidak perlu diisi apa-apa, langsung klik OK.
Perhatian...DILARANG MEMASANG PASSWORD PADA PENGOLAH DATA !
• Kemudian akan muncul menu
Server NT...., klik No
• Selanjutnya akan sampai di menu
utama MS-Windows NT, double klik pada menu Instrument 1 Online.
Catatan : Menu Instrument 1 Offline digunakan untuk
keperluan pengolahan data tanpa penyalaan alat (yang dinyalakan hanya perangkat
komputernya saja). Menu ini misalnya digunakan untuk print out kromatogram yang
belum sempat dilakukan atau untuk melakukan print ulang kromatogram yang sudah
ada.
• Kemudian tunggu sampai masuk ke menu Online Agilent
Chemstation.
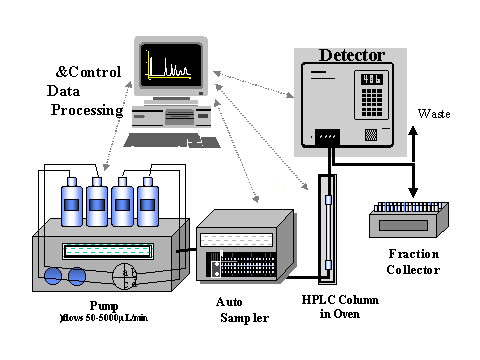
Komponen-Komponen
KCKT
Komponen-komponen
penting dari KCKT dapat dilihat pada Diagram Blok KCKT berikut ini :
 |
| Begini Loh Mekanisme Kerja High Performance Liquid Chromatography (HPLC) |
Pompa (Pump)
Fase gerak
dalam KCKT adalah suatu cairan yang bergerak melalui kolom. Ada dua tipe pompa
yang digunakan, yaitu kinerja konstan (constant pressure) dan pemindahan
konstan (constant displacement). Pemindahan konstan dapat dibagi menjadi dua,
yaitu: pompa reciprocating dan pompa syringe. Pompa reciprocating menghasilkan
suatu aliran yang berdenyut teratur (pulsating),oleh karena itu membutuhkan
peredam pulsa atau peredam elektronik untuk, menghasilkan garis dasar (base
line) detektor yang stabil, bila detektor sensitif terhadapan aliran.
Keuntungan utamanya ialah ukuran reservoir tidak terbatas. Pompa syringe
memberikan aliran yang tidak berdenyut, tetapi reservoirnya terbatas.
Injektor (injector)
Sampel yang akan dimasukkan ke
bagian ujung kolom, harus dengan disturbansi yang minimum dari material kolom.
Ada dua model umum :
a. Stopped Flow
b. Solvent Flowing
Ada tiga tipe dasar injektor yang
dapat digunakan :
a. Stop-Flow: Aliran dihentikan, injeksi
dilakukan pada kinerja atmosfir, sistem tertutup, dan aliran dilanjutkan lagi.
Teknik ini bisa digunakan karena difusi di dalam cairan kecil clan resolusi
tidak dipengaruhi
b. Septum: Septum yang digunakan pada KCKT sama
dengan yang digunakan pada Kromtografi Gas. Injektor ini dapat digunakan pada
kinerja sampai 60 -70 atmosfir. Tetapi septum ini tidak tahan dengan semua
pelarut-pelarut Kromatografi Cair.Partikel kecil dari septum yang terkoyak
(akibat jarum injektor) dapat menyebabkan penyumbatan.
c. Loop Valve: Tipe injektor ini umumnya
digunakan untuk menginjeksi volume lebih besar dari 10 μ dan dilakukan dengan
cara automatis (dengan menggunakan adaptor yang sesuai, volume yang lebih kecil
dapat diinjeksifan secara manual). Pada posisi LOAD, sampel diisi kedalam loop
pada kinerja atmosfir, bila VALVE difungsikan, maka sampel akan masuK ke dalam
kolom.
Kolom (Column)
Kolom adalah jantung
kromatografi. Berhasil atau gagalnya suatu analisis tergantung pada pemilihan
kolom dan kondisi percobaan yang sesuai. Kolom dapat dibagi menjadi dua
kelompok :
a. Kolom analitik : Diameter dalam 2 -6 mm.
Panjang kolom tergantung pada jenis material pengisi kolom. Untuk kemasan
pellicular, panjang yang digunakan adalah 50 -100 cm. Untuk kemasan poros
mikropartikulat, 10 -30 cm. Dewasa ini ada yang 5 cm.
b. Kolom preparatif: umumnya memiliki diameter 6
mm atau lebih besar dan panjang kolom 25 -100 cm.
Kolom umumnya dibuat
dari stainlesteel dan biasanya dioperasikan pada temperatur kamar, tetapi bisa
juga digunakan temperatur lebih tinggi, terutama untuk kromatografi penukar ion
dan kromatografi eksklusi. Pengepakan kolom tergantung pada model KCKT yang
digunakan (Liquid Solid Chromatography, LSC; Liquid Liquid Chromatography, LLC;
Ion Exchange Chromatography, IEC, Exclution Chromatography, EC)
Detektor (Detector)
Suatu detektor
dibutuhkan untuk mendeteksi adanya komponen sampel di dalam kolom (analisis
kualitatif) dan menghitung kadamya (analisis kuantitatif).Detektor yang baik
memiliki sensitifitas yang tinggi, gangguan (noise) yang rendah, kisar respons
linier yang luas, dan memberi respons untuk semua tipe senyawa. Suatu kepekaan
yang rendah terhadap aliran dan fluktuasi temperatur sangat diinginkan, tetapi
tidak selalu dapat diperoleh.
Detektor KCKT yang
umum digunakan adalah detektor UV 254 nm. Variabel panjang gelombang dapat
digunakan untuk mendeteksi banyak senyawa dengan range yang lebih luas.
Detektor indeks refraksi juga digunakan secara luas, terutama pada kromatografi
eksklusi, tetapi umumnya kurang sensitif jika dibandingkan dengan detektor UV.
Detektor-detektor lainnya antara lain:
Detektor Fluorometer -Detektor
Spektrofotometer Massa
Detektor lonisasi nyala -Detektor Refraksi
lndeks
Detektor Elektrokimia -Detektor Reaksi
Kimia
Elusi Gradien
Elusi Gradien
didefinisikan sebagai penambahan kekuatan fasa gerak selama analisis
kromatografi berlangsung. Efek dari Elusi Gradien adalah mempersingkat waktu
retensi dari senyawa-senyawa yang tertahan kuat pada kolom. Dasar-dasar elusi
gradien dijelaskan oleh Snyder.
Elusi Gradien menawarkan beberapa
keuntungan :
a. Total waktu
analisis dapat direduksi
b. Resolusi persatuan
waktu setiap senyawa dalam campuran bertambah
c. Ketajaman Peak
bertambah (menghilangkan tailing)
d. Efek sensitivitas
bertambah karena sedikit variasi pada peak
Gradien dapat
dihentikan sejenak atau dilanjutkan. Optimasi Gradien dapat dipilih dengan cara
trial and error. Tabel 3. 1. berikut ini menunjukkan kompatibilitas dari
bermacam-macarn mode kromatografi cair dengan analisis gradien. Dalam praktek,
gradien dapat diformasi sebelum dan sesudah pompa.
© 2004 Digitized by
USU digital library 6
|
Tabel 3. 1 : Mode
Kompatibilitas dengan Gradien Mode
|
Solven
Gradien
|
|
Kromatografi
Cair padat (LSC)
|
Ya
|
|
Kromatografi
ekslusi
|
Tidak
|
|
Kromatografi
Penukar Ion (IEC)
|
Ya
|
|
Kromatografi
Cair Cair (LLC)
|
Tidak
|
|
Kromatografi
Fasa Terikat (BPC)
|
Ya
|
Pengolahan Data (Data Handling)
Hasil dari
pemisahan kromatografi biasanya ditampilkan dalam bentuk kromatogram pada rekorder.
Suatu tipe Kromatogram dapat dilihat pada Gambar berikut ini
Dari Gambar waktu retensi dan
volume retensi dapat diketahui /dihitung. Lni bisa digunakan untuk
mengidentifikasi secara kualitatif suatu komponen, bila kondisi kerja dapat
dikontrol. Lebar puncak dan tinggi puncak sebanding atau proporsional dengan
konsentrasi dan dapat digunakan untuk memperoleh hasil secara kuantitatif.
Fasa gerak
Di dalam
kromatografi cair komposisi dari solven atau rasa gerak adalah salah satu dari
variabel yang mempengaruhi pemisahan. Terdapat variasi yang sangat luas pada
solven yang digunakan untuk KCKT, tetapi ada beberapa sifat umum yang sangat
disukai, yaitu rasa gerak harus :
1. Murni,
tidak terdapat kontaminan
2. Tdak
bereaksi dengan wadah (packing)
3. Sesuai
dengan defektor
4.
Melarutkan sampel
5. Memiliki
visikositas rendah
6. Bila
diperlukan, memudahkan "sample recovery"
7.
Diperdagangan dapat diperoleh dengan harga murah (reasonable price)
Umumnya,
semua solven yang sudah digunakan langsung dibuang karena prosedur pemumiannya
kembali sangat membosankan dan mahal biayanya. Dari semua persyaratan di atas,
persyaratan 1) s/d 4) merupakan yang sangat penting.
Pola Elusi (Mekanisme Pemisahan) Pada Hplc
Pada HPLC
pemisahan terjadi di dalam kolom, sehingga mekanisme pemisahan atau pola
elusinya seperti pada kromatografi kolom. Gambar di bawah menunjukkan profil
konsentrasi komponen A dan B pada awal dan akhir elusi. Koefisien partisi A
> B, oleh karena itu pada proses migrasi komponen A berada di belakang
komponen B. Bersamaan dengan proses migrasi, terjadi pula efek pelebaran pada
kedua pita yang mengurangi efisiensi pemisahan. Pelebaran pita tidak dapat
dihilangkan secara total, namun dapat dikurangi sehingga pelebaran pita terjadi
jauh lebih lambat daripada pemisahan pita. Dengan demikian pemisahan kedua
komponen dapat terjadi secara sempurna pada panjang kolom yang sesuai.
Profil Konsentrasi Solut A dan B pada Jarak Migrasi
yang Berbeda
Padatan pendukung
pada kromatografi partisi disalut dengan fase diam cair, dan pemisahan senyawa
campuran ditentukan oleh koefisien partisi masing-msing senyawa di antara kedua
fase cair. Pada kedua fase yaitu fase gerak dan fase diam, salah satu
diantaranya harus lebih polar dibanding yang lain. Bila fase diam lebih polar,
disebut kromatografi partisi fase normal. Bila sebaliknya, disebut kromatografi
partisi fase terbalik. Pada fase normal, senyawa polar lebih terbagi ke fase
diam dan tertambat lebih lama dibanding senyawa nonpolar. Pada kromatografi
partisi fase terbalik, terjadi hal yang sebaliknya.
Analisis Kualitatif
Proses
terbawanya solut dari puncak kolom sampai akhir kolom disebut elusi. Apabila
detektor ditempatkan pada ujung akhir kolom, maka akan diperoleh sinyal yang
digambarkan sebagai fungsi waktu, yang disebut kromatogram. Kromatogram akan
memperlihatkan bahwa setiap senyawa meninggalkan kolom sebagai puncak simetri,
sehingga sinyal detektor yang tercatat berbentuk kurva Gauss pada waktu yang
khas untuk setiap senyawa. Oleh karena itu, kromatogram dapat menunjukkan waktu
yang diperlukan untuk elusi. Waktu yang menunjukkan puncak signal disebut waktu
retensi (tR), yang tidak lain adalah waktu yang dibutuhkan analit mulai saat
diinjeksikan hingga terelusi dan keluar dari kolom pada konsentrasi
maksimumnya. Tiap senyawa memiliki waktu retensi yang spesifik pada kondisi
tertentu, antara lain kondisi kolom, tekanan, suhu, laju aliran fase gerak,
dll, sehingga dapat digunakan sebagai salah satu dasar untuk analisis
kualitatif. Beberapa senyawa memiliki waktu retensi yang berdekatan, namun tiap
senyawa hanya memiliki satu waktu retensi saja. Dengan membandingkan waktu
retensi analit dengan waktu retensi senyawa baku maka analit dapat
diidentifikasi.
Analisis Kuantitatif
Analisis Kuantitatif Berdasarkan Tinggi Puncak
Tinggi
puncak diperoleh dengan membuiat garis antara kedua dasar sisi puncak, dan
mengukur tegak lurus dari garis tersebut hingga puncak kromatogram. Apabila
variasi pada keadaan kolom tidak menyebabkan pelebaran puncak, dimana
kromatogram yang diperoleh berupa pita yang sempit dan tajam, maka analisis
kuantitatif lebih baik didasarkan pada tinggi puncak. Pengukuran ini dapat
dilakukan dengan ketelitian tinggi, sehingga data yang diperoleh akan lebih
akurat. Variabel yang perlu dikendalikan pada analisis ini adalah suhu dalam
kolom, laju alir fase gerak, tekanan dalam kolom, dan kecepatan injeksi.
Kesalahan relatif yang disebabkan oleh penginjeksian berkisar antara 5 – 10%.
Analisis Kuantitatif Berdasarkan Luas Puncak
Pengukuran
dengan cara ini tidak dipengaruhi oleh pelebaran pita, oleh karena itu cara ini
lebih disukai daripada pengukuran tinggi puncak. Pada umumnya, instrumen
kromatografi dilengkapi dengan integrator yang memungkinkan pengukuran luas
puncak secara lebih teliti. Bila tidak ada integrator maka pengukuran harus
dilakukan secara manual. Konsentrasi dapat dihitung dengan persamaan:
Cx = Ax / Ap
X Cp
Keterangan :
A = Peak
area = Luas puncak
C =
Konsentrasi
X = sampel
P =
pembanding
Analisis Kuantitatif secara Kalibrasi dengan
Standar
Metode untuk
memperkirakan komposisi suatu campuran yang tidak diketahui adalah dengan
membandingkan terhadap suatu seri larutan baku dengan berbagai konsentrasi.
Setelah pembuatan kromatogram dari masing-masing larutan standar, kemudian
dibuat kurva baku dengan tinggi puncak atau luas puncak sebagai fungsi
konsentrasi. Sumber kesalahan utama pada metode ini terletak pada volume
larutan yang diinjeksikan yang tidak reprodusibel.
Analisis Kuantitatif dengan Standar Internal
Pada metode
ini dapat diperoleh ketelitian tertinggi pada analisis kuantitatif, karena
variasi volume larutan yang diinjeksikan dapat dieliminasi. Pada metode ini
sejumlah standar internal dimasukkan ke dalam tiap larutan standar dan larutan
sampel. Analisis kuantitatif dilakukan dengan rasio luas atau tinggi puncak
analit terhadap standar internal. Senyawa yang digunakan sebagai standar
internal harus terpisah dari analit namun dekat dengan puncak analit.
