Spektrometri atom memang memiliki 3 jenis utama: Spektrometri Serapan Atom (AAS), Spektrometri Emisi Atom (AES), dan Spektrometri Fluoresensi Atom (AFS). Ketiga metode ini memanfaatkan interaksi antara atom dengan cahaya untuk menganalisis komposisi sampel.
Spektrometri Serapan Atom (AAS):
Dalam AAS, atom menyerap radiasi pada panjang gelombang tertentu yang unik untuk setiap unsur. Intensitas radiasi yang diserap digunakan untuk menentukan konsentrasi unsur dalam sampel. AAS sering digunakan untuk menganalisis logam.
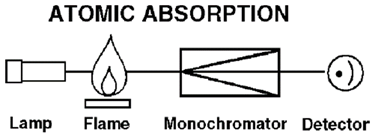 |
| Atomic Absorpsi |
Spektrometri Emisi Atom (AES):
AES mengukur cahaya yang dipancarkan oleh atom setelah mereka dieksitasi, misalnya dengan pemanasan dalam api, plasma, atau busur. Intensitas cahaya yang dipancarkan memberikan informasi tentang konsentrasi unsur dalam sampel.
 |
| Atomic Emisi |
Spektrometri Fluoresensi Atom (AFS):
AFS mengukur cahaya yang dipancarkan oleh atom setelah mereka dieksitasi oleh radiasi UV. Berbeda dengan AES, AFS lebih sensitif dan sering digunakan untuk menganalisis senyawa organik.
 |
| Atomic Fluoresen |
Selain tiga jenis utama ini, terdapat juga beberapa variasi dan modifikasi dari setiap metode, misalnya sistem api (F AAS), uap dingin (CV AAS), pembangkit hidrida (HG AAS), dan tungku grafit (GF-AAS) dalam AAS, atau spektrometri emisi atom plasma induksi-kopling ablasi laser (ICP-AES) dalam AES.
 |
| Gambar. Generasi pertama SSA |
Prinsip Kerja AAS:
1. Atomisasi Sampel:
Sampel yang mengandung unsur target (logam atau metaloid) diubah menjadi atom bebas dalam fase gas. Proses ini dapat dilakukan dengan beberapa metode, misalnya dengan menggunakan nyala api (flame), tungku grafit (graphite furnace), atau metode lain yang sesuai.
2. Penerapan Sumber Cahaya:
Sumber cahaya yang sesuai dengan panjang gelombang yang diserap oleh atom target disinari ke sampel yang telah diatomisasi. Sumber cahaya biasanya berupa lampu katoda berongga (hollow cathode lamp) yang menghasilkan spektrum garis yang khas untuk unsur yang sedang dianalisis.
3. Pengukuran Absorbansi:
Atom-atom bebas dalam sampel akan menyerap cahaya pada panjang gelombang tertentu. Jumlah cahaya yang diserap oleh atom-atom ini proporsional dengan konsentrasi unsur yang sedang dianalisis. Absorban yang diserap diukur oleh detektor.
4. Analisis Data:
Sinyal yang dihasilkan oleh detektor diolah dan diinterpretasikan untuk menentukan konsentrasi unsur target dalam sampel. Data ini dapat berupa grafik absorbansi versus konsentrasi, yang kemudian digunakan untuk menentukan konsentrasi sampel.
Komponen Utama AAS:
Sumber Cahaya: Lampu katoda berongga (hollow cathode lamp).
 |
| hollow cathode lamp |
katoda berbentuk cekung dilapisi logam murni, anoda terbuat dari wolfram, Kedua elektroda berada dlm tabung gelas tertutup yang diisi gas mulia (He, Ne, Ar) pada tekanan rendah (2-3 mmHg atau 1-5 torr).
Sistem Atomisasi: Pembakar nyala (flame), tungku grafit, dll.
Sistem pengatoman dengan tungku grafit
Sistem pengatoman dengan pembentukan hidrida
Sistem pengatoman dengan pembentukan uap dingin
SISTEM PENGATOMAN DENGAN NYALA
1.Pengubahan larutan menjadi aerosol (pada nebulizer)
2.Penguapan pelarut, sehingga terjadi partikel garam padat halus
3.Partikel garam pada suhu tinggi menjadi uap garam (sublimasi)
4.Disosiasi molekul-molekul uap garam menjadi atom-atom netral
Monokromator: Alat untuk memilih panjang gelombang cahaya yang akan digunakan.
Detektor: Alat untuk mengukur absorbansi cahaya.
Sistem Pengolah Data: Komputer untuk memvisualisasikan dan mengolah data
Aplikasi AAS:
- Analisis kandungan logam dalam air, tanah, makanan, dan lingkungan.
- Penentuan kadar logam dalam sampel biologis, seperti darah dan urine.
- Pengujian kualitas bahan mentah dan produk akhir di berbagai industri.
- Pemeriksaan kandungan logam berat dalam sampel yang mencurigakan, misalnya sampel tanah yang dicemar
Sensitivitas: AAS sangat sensitif dan dapat mendeteksi konsentrasi logam yang sangat rendah.
Selektivitas: AAS selektif dan dapat menentukan kadar satu unsur tertentu tanpa terganggu oleh keberadaan unsur-unsur lain dalam sampel
Ketelitian: AAS dapat memberikan hasil analisis yang akurat dan presisi.
INTERFERENSI (Gangguan)
Jake dalam atomizer terdapat spesies lain yang menyerap radiasi pada panjang gelombang yang overlap/sangat dekat dengan daerah serapan analat sehingga pemisahan dengan monokromator tidak dimungkinkan Jarang terjadi karena lampu hollow cathode sudah memiliki range panjang gelombang yang sangat sempit.
Terbentuknya partikulat: menghamburkan cahaya sehingga menurunkan intensitas radiasi
Unsur tertentu dapat terionisasi dlm nyala (menjadi ion positif)
Solusi: menambahkan unsur lain (alkali dan alkali tanah) yang memiliki Energi ionisasi lebih rendah (misal: K atau Na)
Pembentukan senyawa refraktori:
reaksi logam dg anion tertentu membentuk senyawa yg stabil terhadap panas, misal:
Ca + fosfat --->Ca3(PO4)2 atau Ca2P2O7 (kalsium pirofosfat)
Al, Ti, Mo, V + O atau OH ----> oksida/hidroksida tahan panas
MENGATASI GANGGUAN KIMIA
menambahkan releasing agent (unsur pembebas), misal lantanum (La) atau EDTA :
Ca + EDTA ----> Ca-EDTA (tdk refractory)
La + fosfat ----> La- fosfat (Ca menjadi bebas dari fosfat)








