Pengertian Katalis (Katalisator)
Katalis adalah suatu senyawa kimia yang menyebabkan
reaksi menjadi lebih cepat untuk mencapai kesetimbangan tanpa mengalami
perubahan kimiawi diakhir reaksi. Katalis tidak mengubah nilai kesetimbangan
dan berperan dalam menurunkan energi aktivasi.
Dalam penurunan energi aktivasi ini, maka energi
minimum yang dibutuhkan untuk terjadinya tumbukan berkurang sehingga terjadinya
reaksi berjalan cepat. Katalis pada umumnya mempunyai sifat-sifat sebagai
berikut: aktivitas, stabilitas, selektivitas, umur, regenerasi dan kekuatan
mekanik. Secara umum katalis mempunyai 2 fungsi yaitu mempercepat reaksi menuju
kesetimbangan atau fungsi aktivitas dan meningkatkan hasil reaksi yang
dikehendaki atau fungsi selektivitas.
Katalis sebagai suatu substansi kimia mampu
mempercepat laju reaksi kimia yang secara termodinamika dapat berlangsung. Hal
ini disebabkan karena kemampuannya mengadakan interaksi dengan paling sedikit
satu molekul reaktan untuk menghasilkan senyawa antara yang lebih aktif.
Interaksi ini akan dapat meningkatkan ketepatan
orientasi tumbukan, meningkatkan konsentrasi akibat lokalisasi reaktan,
sehingga meningkatkan jumlah tumbukan dan membuka alur reaksi dengan energi
pengaktifan yang lebih rendah. Katalis dapat dibagi ke dalam 3 komponen yakni
situs aktif, penyangga atau pengemban dan promotor. Situs aktif berperan dalam
reaksi kimia yang diharapkan, penyangga berperan
dalam memodifikasi komponen
aktif, menyediakan permukaan yang luas, dan meningkatkan
stabilitas katalis, sementara itu promotor berperan dalam meningkatkan atau
membatasi aktivitas katalis serta berperan dalam struktur katalis.
Katalis Homogen
Katalis homogen adalah katalis yang berada dalam
fase yang sama. Katalis homogen umumnya breaksi dengan satu atau lebih pereaksi
untuk mebentuk suatu perantara kimia yang selanjutnya bereaksi membentuk produk
akhir reaksi, dalam suatu proses yang memulihkan katalisnya.
Berikut ini merupakan skema umum reaksi katalitik,
di mana C melambangkan katalisnya:
A + C —►
AC (1)
B + AC —► AB + C (2)
B + AC —► AB + C (2)
Meskipun katalis (C) termakan oleh reaksi 1, namun
selanjutnya dihasilkan kembali oleh reaksi 2, sehingga untuk reaksi
keseluruhannya menjadi :
A + B + C
—► AB + C
Katalis Heterogen
Katalis heterogen adalah katalis yang ada dalam
fase bebeda dengan pereaksi dalam reaksi kimia yang dikatalisisnya. Satu contoh
sederhana untuk katalisis heterogen yaitu bahwa katalis menyediakan suatu
permukaan di mana pereaksi-pereaksi (atau substrat) untuk sementara terjerat.
Ikatan dalam substrat-substrat menjadi lemah
sedemikian sehingga memadai terbentuknya produk barn. Ikatan atara produk dan
katalis lebih lemah, sehingga akhirnya terlepas.
Katalis Ziegler-Natta
Katalis Ziegler-Natta adalah campuran antara
senyawa-senyawa titanium seperti titanium (III) klorida, TiCl3, atau
titanium (IV) klorida, TiCl4, dan senyawa-senyawa aluminium seperti
aluminium trietil, A1(C2H5)3.
Pada proses polimerisasi alolefin menggunakan
katalis Ziegler-Netta, AlEt3 dapat mereduksi TiCl4 menjadi TiCl3
dan atom klor digantikan dengan gugus gugus etil. Dasar polimerisasi sebanding
dengan jumlah total TiCl3 dan pengaruh olefin serta konsentrasi AlEt3.
Fungsi Katalis
Fungsi katalis yaitu memperbesar laju reaksinya
(mempercepat reaksi) dengan cara memperkecil energi aktifasi suatu reaksi dan
dibentuknya tahap- tahap reaksi yang barn. Dengan menurunnya energi aktifasi
maka pada suhu yang sama reaksi dapat berlangsung lebih cepat.
Satu yang harus diketahui tentang prinsip kerja
katalis adalah bahwa katalis tersebut tetap ikut dalam jalannya reaksi, tetapi
pada kondisi akhir, katalis akan keluar lagi dalam bentuk yang sama.
Sifat-sifat kimia katalis akan sama sebelum dan sesudah mengkatalis suatu
reaksi.
Pentingnya katalis ditunjukkan oleh kenyataan bahwa
lebih dari 75% proses produksi bahan kimia di Industri disintesis dengan
bantuan katalis. Contoh proses kimia yang sangat penting misalnya sintesis
metanol dari syngas (CO dan H2) dikatalisis oleh Zn0/Cr203,
dan reaksi water gas shift (WGS), dikatalisis oleh besi oksida atau oksida
campuran Zn, Cu maupun Cr.
CO + 2H2O
-> CO2 + H2
Teknologi katalis telah digunakan dalam industri
kimia lebih dari 100 tahun lamanya dan penelitian serta pengembangan teknologi
katalis telah menjadi semacam bidang kekhususan kimia.
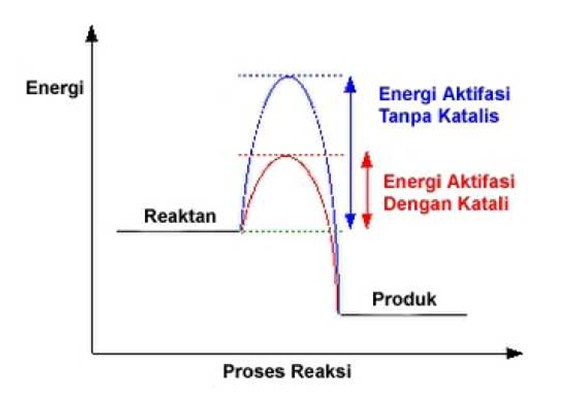
Suatu reaksi eksoterm AB(g) + C(g) —► AC(g) + B(g).
Reaksi ini berlangsung lambat, karena energi aktivasinya (Ea) lebih besar
dibanding energi molekulnya. Hanya sebagian kecil molekul yang mencapai Ea.
 |
| Reaksi Eksoterm |
Oleh karena itu untuk mempercepat reaksi ini,
ditambahkan suatu katalis. Apa fungsi katalis? Mengapa katalis dapat
mempercepat reaksi? Bagaimana cara katalis mempercepat reaksi itu? Berdasarkan
diagram di atas, Ea’ dengan katalis lebih rendah. Mengapa?
Katalis itu berupa zat yang dicampurkan dengan
reaktan. Jika reaksi di atas tanpa katalis, AB dan C bertumbukan sampai
mencapai Ea yang relatif tinggi. Karena umumnya energi molekulnya rendah, jadi
tumbukan yang teijadi tidak efektif. Ea sangat sulit dicapai. Untuk itu maka
ditambahkan zat yang bertindak sebagai katalis.
Ternyata pada saat katalis dicampurkan reaksi makin cepat.
Jelas bahwa katalis itu dapat mempengaruhi salah
satu reaktan. Misalnya dalam reaksi ini katalis cocok sifatnya dengan AB. Maka
seperti robot AB tertarik ke katalis membentuk KAB. KAB tergolong kompleks
teraktivasi yang merupakan tahap reaksi hipotesis; KAB kemudian terurai menjadi
KA dan B.
Setelah itu teijadi tahap reaksi berikutnya, yaitu
C ditarik oleh KA menjadi KAC yang kemudian langsung K lepas dan terbentuklah
AC. Mekanisme reaksi di atas adalah :
K + AB —►
KAB —► KA + B (lambat)
KA + C —► KAC -> K + AC (cepat)
K + AB + C —► K + AC + B
KA + C —► KAC -> K + AC (cepat)
K + AB + C —► K + AC + B
Jadi katalis ikut ambil bagian dalam reaksi,
memberi jalan barn melalui mekanisme reaksi barn yang energi aktivasinya lebih
rendah, kemudian terbentuk kembali dalam keadaan yang sama.
Penggolongan Katalis
Katalis dapat digolongkan ke dalam 2 jenis, yaitu
katalis homogen dan katalis heterogen. Dalam reaksi dengan katalis homogen,
katalis berada dalam fase yang sama dengan reaktan. Biasanya, semua reaktan dan
katalis berada dalam satu fasa tunggal cair atau gas. Produksi biodiesel dengan
katalis homogen secara umum menggunakan katalis H2SO4, NaOH dan KOH. Dalam
reaksi dengan katalis heterogen, katalis dan reaktan berada dalam fase yang
berbeda.
Katalis heterogen cenderung lebih mudah untuk
dipisahkan dan digunakan kembali dari campuran reaksi karena fasa yang
digunakan berbeda dengan produk reaksinya. Katalis heterogen juga lebih mudah
dibuat dan mudah diletakkan pada reaktor karena fasa yang berbeda dengan
pereaktannya. Biasanya katalis heterogen yang digunakan berupa fase padat.
Adanya beda fasa pada katalis dan pereaktan
menjadikan mekanisme reaksi menjadi sangat kompleks. Fenomena antarmuka menjadi
sesuatu yang sangat penting dan berperan. Laju reaksi dikendalikan oleh
fenomena-fenomena adsorbsi, absorbsi dan desorbsi. Reaksi cairan atau gas
dengan adanya katalis padat adalah contoh yang khas.
Keuntungan penggunaan katalis heterogen adalah katalisnya dapat dipisahkan dengan penyaringan dari produk bila reaksi telah selesai. Banyak proses industri yang menggunakan katalis heterogen, sehingga proses dapat berlangsung lebih cepat dan biaya produksi dapat dikurangi Beberapa logam ada yang dapat mengikat cukup banyak molekul-molekul gas pada permukannya, misalnya Ni, Pt, Pd dan V.
Gaya tarik menarik antara atom logam dengan molekul
gas dapat memperlemah ikatan kovalen pada molekul gas, dan bahkan dapat
memutuskan ikatan itu. Satu contoh sederhana untuk katalisis heterogen yaitu
bahwa katalis menyediakan suatu permukaan di mana pereaksi-pereaksi (atau
substrat) untuk sementara terserap. Ikatan dalam substrat- substrat menjadi
sedemikian lemah sehingga memadai terbentuknya produk baru. Ikatan atara produk
dan katalis lebih lemah, sehingga akhirnya terlepas.
Katalis dapat bekerja dengan membentuk senyawa
antara atau mengabsorpsi zat yang direaksikan. Sehingga katalis dapat
meningkatkan laju reaksi, sementara katalis itu sendiri tidak mengalami
perubahan kimia secara permanen.
Cara kerjanya yaitu dengan menempel pada bagian substrat tertentu dan pada akhirnya dapat menurunkan energi pengaktifan dari reaksi, sehingga reaksi berlangsung dengan cepat. Suatu reaksi yang menggunakan katalis disebut reaksi katalis dan prosesnya disebut katalisme.
Cara kerjanya yaitu dengan menempel pada bagian substrat tertentu dan pada akhirnya dapat menurunkan energi pengaktifan dari reaksi, sehingga reaksi berlangsung dengan cepat. Suatu reaksi yang menggunakan katalis disebut reaksi katalis dan prosesnya disebut katalisme.
Penggolongan Katalis berdasarkan
Keberadaan di Alam
a. Katalis Biokimia
- Disebut juga enzim. Merupakan senyawa protein berukuran koloid.
- Dijumpai dalam sistem biokimia dan makhluk hidup.
Contoh: enzim-enzim dalam sistem pencernaan tubuh
manusia enzim-enzim dalam tumbuhan
- Bekerja pada suhu ambient.
- Setiap enzim mempunyai suhu optimum (suhu operasi ketika aktivitasnya mencapai maksimum). Peningkatan suhu di atas suhu optimumnya akan mengakibatkan kerusakan enzim (denaturasi protein).
b. Katalis yang dibuat oleh
manusia (man-made catalyst)
Bekerja pada suhu relatif tinggi. Sebagian besar
berupa katalis padat. Contoh: Katalis V2O5 untuk reaksi oksidasi
SO2 : SO2
(g) + ½ O2 (g) ↔ SO3 (g)
Katalis Fe-base untuk reaksi sintesis ammonia
N2 (g) + 3 H2 (g) ↔ 2 NH3 (g)
Katalis oksida Cu-Zn untuk reaksi sintesis methanol
CO (g) + 2 H2 (g) ↔ CH3OH (g)
Katalis Fe-base untuk reaksi sintesis ammonia
N2 (g) + 3 H2 (g) ↔ 2 NH3 (g)
Katalis oksida Cu-Zn untuk reaksi sintesis methanol
CO (g) + 2 H2 (g) ↔ CH3OH (g)
Karakteristik Katalis Padat
Kinerja katalis dipengaruhi oleh beberapa parameter
yakni aktivitas, selektivitas, deaktivasi, aliran fluida dan stabilitas
katalis. Kinerja katalis juga dipengaruhi oleh karakteristik
dari katalis itu sendiri. Karakter-karakter yang
mempengaruhi kinerja katalis diantaranya pemilihan komponen aktif atau situs
aktif, luas permukaan katalis, serta sifat kebasaan dan keasaman permukaan.
Aktivitas dan selektivitas dicapai sebgai keadaan
optimum dengan menentukan material dan metode preparasi yang sesuai. Pada
katalis heterogen padat diyakini bahwa tidak seluruh permukaannya bereaksi.
Hanya situs tertentu pada permukaan katalis yang berperan dalam reaksi,
situs-situs tersebut disebut dengan situs aktif. Situs aktif dapat berupa atom
tak berikatan yang dihasilkan dari ketidakseragaman permukaan atau atom dengan
sifat kimia yang memungkinkan interaksi dengan atom atau molekul yang
teradsorbsi reaktan. Suatu reaksi dengan katalis heterogen padat dari reagen A
menjadi produk B berlangsung sesuai langkah-langkah dalam Gambar 2.1.
- Transpor reaktan A dari cairan bulk ke mulut pori permukaan luar pelet katalis,
- Difusi reaktan A dari mulut pori melalui pori katalis untuk mengisi permukaan dalamnya.
- Adsorpsi reaktan A pada permukaan katalis
- Reaksi A pada permukaan katalis menghasilkan produk B
- Desorpsi produk B dari permukaan katalis
- Difusi produk B dari bagian depan pori ke mulut pori permukaan luar katalis,
- Transfer produk B dari mulut pori pada permukaan luar katalis ke cairan bulk.
Mekanisme tersebut sangat terkait dengan fenomena
adsorpsi. Setidaknya satu dari reaktan teradsorpsi pada permukaan katalis.
Mekanisme adsorpsi dapat dibedakan menjadi dua, yaitu adsorpsi secara fisika
(fisisorpsi) dan secara kimia (kemisorpsi). Pada proses fisisorpsi, interaksi
yang terjadi antara adsorbat dan adsorben adalah gaya van der Waals. Molekul
yang terikat lebih lemah dan energi yang dilepaskan relatif rendah, sekitar 20
kJ/mol. Sedangkan pada proses kemisorpsi, interaksi adsorbat dan adsorben
tersedia melalui pembentukan ikatan yang lebih kuat.
Permukaan katalis mencakup permukaan eksternal dan
internal pori-pori. Untuk material yang sangat berpori, luas permukaan internal
pori-pori jauh lebih tinggi daripada luas permukaan eksternal. Distribusi
ukuran pori katalis dipengaruhi oleh kondisi preparasi dan jumlah masukan
komponen aktif. Biasanya terdapat distribusi ukuran pori yang luas pada
katalis, akan tetapi, katalis juga dapat dirancang untuk memiliki distribusi
ukuran pori yang sangat kecil. Pada katalis, situs-situs aktif tersebar di
seluruh matriks berpori. Dalam kondisi temperatur dan tekanan yang sesuai, gas
secara bertahap dapat terserap pada permukaan padat dan akhirnya menyebabkan
cakupan menyeluruh.
Permukaan katalis dapat memiliki karakteristik asam maupun basa. Teori Brønsted-Lowry mendefinisikan asam sebagai zat atau materi pemberi proton, sedangkan basa didefinisikan sebagai zat atau materi penerima proton. Sementara itu, Lewis mendefinisikan asam sebagai zat atau materi akseptor pasangan elektron dan basa didefinisikan sebagai zat atau materi pendonor pasangan eletron.
Definisi asam-basa dapat digunakan untuk
menerangkan fenomena asam- basa yang ditunjukkan sebagai karakteristik
permukaan katalis. Hal ini perlu untuk menerangkan gugus aktif pada material
tersebut, baik berupa gugus asam maupun basa. Penentuan letak gugus aktif ini
sangat rumit, namun konsep sederhana yang dapat dilakukan adalah dengan
menghubungkan sifat permukaan dengan adanya ikatan terhadap asam maupun basa
yang teradsorpsi.
Pengertian keasaman atau kebasaan permukaan padatan
meliputi aspek kekuatan asam atau basa dan jumlah gugus asam atau basanya serta
pusat asam atau basa dari berbagai macam padatan. Jumlah basa pada permukaan
biasanya dinyatakan sebagai banyaknya senyawa asam yang dapat teradsorpsi dalam
suatu berat sampel per satuan luas permukaan padatan, sementara itu jumlah asam
pada permukaan berarti sebaliknya. Jumlah asam atau basa yang teradsorpsi
secara kimia pada permukaan padatan menunjukkan banyaknya gugus aktif pada
permukaan padatan.
Kelemahan katalis
Di industri kimia, masalah terutama berkaitan
dengan :
1. Pemisahan (separation),
Problem pemisahan katalis dari zat pereaksi maupun
produk lebih sering ditemui pada sistem katalis homogen. Karena katalis homogen
larut dalam campuran, pemisahan tidak cukup dilakukan dengan penyaringan atau
dekantasi. Teknik yang umum digunakan adalah destilasi atau ekstraksi produk
dari campuran, misalnya katalis asam-basa pada reaksi esterifikasi biodiesel
dipisahkan dengan ekstraksi untuk kemudian campuran sisa reaktan-katalis yang
tertinggal dialirkan lagi menuju bejana reaksi.
Namun demikian, ada beberapa katalis istimewa dari
senyawa komplek logam yang didesain sedemikian rupa sehingga bisa terpisah atau
mengendap setelah reaksi tuntas. Kasus pemisahan untuk katalis heterogen lebih
mudah ditanggulangi karena sudah terpisah dengan sendirinya tanpa membutuhkan
usaha lain.
2. Daur ulang (recycle) dan Usia
(life time)
Daur ulang dan usia katalis memiliki kaitan. Selama
bisa dipisahkan, katalis homogeny boleh dikatakan tetap aktif dan memiliki usia
yang sangat panjang bahkan nyaris tak terhingga dan bisa digunakan
berulang-ulang.
3. Deaktifasi katalis
Katalis homogen mungkin tidak dapat lagi digunakan
jika mengalami deaktifasi akibat teracuni atau perubahan struktur akibat proses
ektrim. Katalis heterogen memiliki takdir berbeda. Sering kali katalis
heterogen harus diaktifasi dulu sebelum siap digunakan, misalnya dengan jalan
direduksi atau dioksidasi.
Setelah mengalami proses reaksi berkali-kali,
“kereaktifan katalis tersebut pelan-pelan menurun akibat perubahan
mikrostruktur maupun kimianya, misal terjadi penggumpalan (clustering), migrasi
partikel aktif membentuk Kristal baru (sintering), oksidasi, karbonisasi,
maupun teracuni (poisoned)”. Untuk mengembalikan reaktifitas katalis heterogen
perlu dilakukan regenerasi dengan cara, misalnya kalsinasi, reduksi-oksidasi
kembali, atau pencucian dengan larutan aktif. Seringkali proses regenerasi
tidak dapat mengembalikan 100% kereaktifan katalis sehingga pada saatnya nanti
katalis tersebut akhirnya “mati” juga dan perlu diganti yang baru.
Cara Kerja Katalis
Cara kerjanya
yaitu dengan menempel pada bagian
subtrat tertentu dan pada akhirnya dapat
menurunkan energi pengaktifan dari reaksi, sehingga reaksi berlangsung dengan
cepat
Katalis memungkinkan reaksi berlangsung lebih cepat
atau memungkinkan reaksi pada suhu lebih rendah akibat perubahan yang dipicunya
terhadap pereaksi. “Penurunan energi aktivasi reaksi disebabkan oleh
terjadinya pembentukan alur atau
mekanisme reaksi yang berbeda (yakni antara reaksi tanpa katalis dan
reaksi dengan katalis). Bahkan, untuk suatu jenis reaksi yang sama, alur atau
mekanisme reaksi yang terbentuk akibat penggunaan suatu katalis tertentu akan
berbeda dengan alur atau mekanisme reaksi yang terbentuk akibat penggunaan
katalis yang lain.
Dengan demikian, katalis hanya bersifat memberikan
alternatif. Berdasarkan teori keadaan-transisi
(atau teori kompleks aktif),
katalis mampu menurunkan hambatan energi potensial (potential
energy barrier) yang harus dilalui oleh reaktan-reaktan untuk membentuk
produk-produk reaksi.
Katalis mempunyai tiga fungsi katalitik
Katalis mempunyai tiga fungsi katalitik yaitu:
1. Aktivitas
Aktivitas merupakan kemampuan katalis untuk memberikan produk reaksi yang diinginkan (dalam jumlah tinggi) dari sekian banyak produk yang mungkin dihasilkan. Produk yang diinginkan tadi sering disebut sebagai yield sedangkan banyaknya bahan baku yang berhasil diubah menjadi aneka produk dikatakan sebagai konversi.
Yield = %selektifitas x konversi
Peningkatan aktivitas tersebut memberikan beberapa
keuntungan sbb:
- Kecepatan reaksi yang lebih tinggi untuk kondisi operasi yang sama.
- Kecepatan reaksi yang sama, tetapi dengan jumlah produk yang lebih tinggi atau ukuran reaktor yang lebih kecil.
- Kecepatan reaksi yang sama pada kondisi yang lebih lunak (berupa suhu atau tekanan operasi yang lebih rendah), dengan yield meningkat, operasi menjadi lebih mudah, deaktivasi berkurang, dan selektivitas yang lebih baik.
2. Selektivitas atau Spesifisitas
Selektivitas atau spesifisitas berkaitan dengan kemampuannya mengarahkan suatu reaksi.
3. Stabilitas atau Lifetime
Stabilitas atau lifetime berkaitan dengan kemampuannya menahan hal- hal yang dapat mengarahkan terjadinya deaktivasi katalis (dapat dimaknai sebagai Kemampuan sebuah katalis untuk menjaga aktifitas, produktifitas dan selektifitasnya dalam jangka waktu tertentu).
Untuk setiap reaksi yang dikatalisisnya, katalis
harus mempunyai aktivitas kimia, selektivitas, dan stabilitas yang cukup
tinggi.
Deaktivasi Katalis
Seiring dengan berlangsungnya proses, katalis dapat
mengalami perubahan sifat kimia dan fisika secara reversibel maupun ireversibel
yang mengarah kepada terjadinya penurunan (atau kehilangan) aktivitasnya. Semua
katalis akan mengalami penurunan (atau kehilangan aktivitasnya sepanjang waktu
penggunaan (time on stream, TOS). Peristiwa inilah yang dinamakan deaktivasi.
Deaktivasi reversibel bersifat sementara, sehingga
katalis dapat diaktifkan kembali dan diregenerasi; sedangkan deaktivasi
ireversibel bersifat permanen, sehingga harus dilakukan penggantian katalis
baru. Proses deaktivasi dapat berlangsung:
- sangat cepat, seperti pada katalis-katalis perengkahan (cracking) hidrokarbon, atau
- sangat lambat, seperti pada katalis besi promoted untuk reaksi sintesis amonia, yang dapat digunakan selama beberapa tahun tanpa kehilangan aktivitas secara berarti (signifikan). Deaktivasi katalis dapat mempengaruhi kinerja reaktor. Penurunan jumlah active sites katalis dapat menurunkan aktivitas katalitiknya. Katalis yang telah terdeaktivasi harus diregenerasi atau bahkan diganti secara periodik.
Dengan mengetahui hal-hal yang dapat menyebabkan
deaktivasi, bagaimana deaktivasi dapat mempengaruhi performa katalis, bagaimana
mencegah terjadinya deaktivasi, serta bagaimana meregenerasi katalis yang telah
terdeaktivasi, maka persoalan deaktivasi ini dapat diminimasi.
Ada 3 macam penyebab deaktivasi secara garis besar,
yakni:
1. Fouling (pengerakan)
Deaktivasi katalis akibat pengerakan pada umumnya berlangsung cepat. Pengerakan terjadi jika ada zat-zat dalam reaktor (bisa reaktan, produk, atau intermediet) terdeposit di atas permukaan katalis dan menutup pori-pori (atau active sites) katalis secara fisik. Karbon (coke/kokas) merupakan bentuk kerak yang paling umum, dan proses pembentukannya dinamakan coking. Misalnya, pembentukan coke (C) pada reaksi perengkahan hidrokarbon dengan katalis silika-alumina:
C10H22 →
C5H12 + C4H10 + C(s)
Bentuk coke yang terbentuk bergantung kepada jenis
katalis, suhu, dan tekanan parsial senyawasenyawa karbonnya.
Beberapa hal yang dapat dilakukan untuk meminimasi coking:
Beberapa hal yang dapat dilakukan untuk meminimasi coking:
- Mengoperasikan reaktor dengan waktu tinggal yang singkat menambahkan hidrogen ke dalam aliran proses, untuk mengkonversi karbon (fase gas) menjadi metana
- meminimasi suhu upstream dari unggun (bed) katalis, karena karbon (fase gas) kurang mudah terbentuk pada suhu rendah.
2. Poisoning (peracunan), dan 3. Deaktivasi katalis
akibat peracunan pada umumnya berlangsung lambat.
Peracunan disebabkan oleh adsorpsi kimia (chemisorption) zat-zat dalam aliran proses. Zat ini kemudian menutup atau memodifikasi active sites pada katalis. Racun dapat menyebabkan perubahan morfologi permukaan katalis, baik melalui rekonstruksi permukaan maupun relaksasi permukaan, atau memodifikasi ikatan antara katalis logam dengan supportnya.
Zat yang bisa menjadi racun pada umumnya adalah
pengotor (impurity) dalam aliran umpan, namun produk dari reaksi yang
diinginkan pun bisa berperan sebagai racun.
Ada 3 jenis utama racun, yaitu:
1. Molekul-molekul dengan heteroatom
yang reaktif (misal: sulfur)
2. Molekul-molekul dengan ikatan
kompleks antar atom (misal: hidrokarbon tak jenuh)
3. Senyawa-senyawa logam atau
ion-ion logam (misal: Hg, Pd, Bi, Sn, Cu, Fe)
Katalis Enzinm dan Reaksi dua arah
Enzim Katalase
Dalam sel makhluk hidup, reaksi-reaksi kimia dapat
berlangsung dengan cepat karena adanya katalisator hidup atau biokatalisator
yaitu Enzim.
Enzim merupakan biokatalisator artinya enzim ialah
zat yang dapat mempercepat reaksi biologi tanpa mengalami perubahan struktur
kimia. Enzim merupakan protein bermolekul besar dengan bobot molekul mencapai
ribuan. Enzim merupakan pengatur suatu reaksi, berikut ini ialah contoh reaksi
yang diatur oleh enzim.
Contohnya:
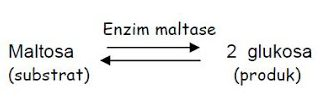
Enzim katilase ialah suatu senyawa makromolekuler
sebagai katalis dalam aktifitas reaksi tertentu yang terjadi di dalam tubuh
organisme. Bahan tempat enzim bekerja disebut dengan substrat. Dalam contoh
reaksi di atas substratnya ialah maltosa. Bahan baru atau materi yang dibentuk
sebagai hasil reaksi disebut produk. Dalam contoh reaksi diatas hanya ada 1
produk yakni glukosa. Enzim yang mengkatalisis ialah maltase.
Reaksi Dua Arah
Reaksi tersebut dapat berlangsung ke arah
sebaliknya. Dengan kata lain reaksinya dua arah “reversible”, maltosa dapat
berubah menjadi glukosa dan glukosa dapat merubah menjadi maltosa. Enzim yang
bekerja di kedua reaksi ialah maltase.
Jika terdapat maltosa lebih banyak dari pada
glukosa, reaksi berlangsung dari kiri ke kanan. Sebaliknya jika glukosa
terdapat lebih banyak dari pada maltosa, maka reaksi berlangsung dari kanan ke
kiri.
Contoh Penggunaan Katalis Dalam
Industri
Katalis terutama banyak dipergunakan untuk membantu
dalam proses industri seperti dalam pengilangan minyak bumi dan proses produksi
bahan kimia umum atau kimia khusus. Selain dikedua jenis industri tersebut,
katalis juga dipergunakan dalam proses produksi produk makanan, pembangkit
listrik tenaga nuklir, kendaraan, dan untuk kegiatan pengendalian pencemaran.
Dalam proses di kilang minyak bumi, katalis yang
banyak dipergunakan adalah katalis reforming, isomerasi dan hydrocracking.
Fungsi katalis-katalis tersebut pada dasarnya untuk membantu memecah rantai
senyawa karbon. Dengan bantuan katalis tersebut minyak mentah {crude oil) dapat
diproses sehingga dapat diperoleh variasi turunannya seperti premium, kerosin,
avtur, dan produk lainnya tergantung tingkat pemutusan rantai karbonnya.
Untuk industri kimia, kebanyakan katalis yang
digunakan adalah katalis yang membantu pembentukan {syntetic catalysts) seperti
katalis hidrogenasi, katalis oksidasi, dll. Beberapa katalis yang sering
dipakai dalam produksi bahan kimia antara lain: VynilAcetate Monomer (VAM),
Purified Terepthalic Acid (PTA) dan proses hidrogenisasi.
Untuk bidang lingkungan, katalis tertentu dapat
digunakan untuk mendestruksi senyawa yang menghasilkan bau sehingga berfungsi
sebagai deodorant. Ada juga katalis yang bisa memecah rantai senyawa organik
volatile (VOC) sehingga dapat digunakan untuk destruksi senyawa berbahaya
tersebut.