Belajar Kimia-Jika kita
memotong-motong sebatang kapur menjadi bagian-bagian sampai yang terkecil, maka
bagian terkecil itu adalah atom. Teori atom sudah berkembang sebelum jaman
Masehi. Bahkan dalam Alquran sudah disebutkan materi yang terkecil yaitu dengan
istilah dzarrah.
1.Teori
Atom Dalton
 |
| Model Atom Dalton Bola Pejal |
John Dalton tahun 1805 mengemukakan hipotesa tentang atom berdasarkan hukum kekekalan
massa (Lavoisier) dan hukum perbandingan tetap (Proust).
Teori yang diusulkan Dalton:
- Atom merupakan bagian terkecil dari materi yang sudah tidak dapat dibagi lagi.
- Atom digambarkan sebagai bola pejal yang sangat kecil, suatu unsur memiliki atom-atom yang identik dan berbeda untuk unsur yang berbeda.
- Atom-atom bergabung membentuk senyawa dengan perbandingan bilangan bulat dan sederhana. Misalnya air terdiri atom-atom hidrogen dan atom-atom oksigen.
- Reaksi kimia merupakan pemisahan atau penggabungan atau penyusunan kembali dari atom-atom, sehingga atom tidak dapat diciptakan atau dimusnahkan.
Hipotesa Dalton digambarkan dengan model atom
sebagai bola pejal
Kelebihan Teori Atom Dalton: Mulai
membangkitkan minat terhadap penelitian mengenai model atom
Kelemahan Teori atom Dalton: tidak dapat menerangkan suatu larutan dapat menghantarkan listrik. Bagaimana mungkin suatu bola pejal dapat menghantarkan listrik, padahal listrik adalah elektron yang bergerak. Berarti ada partikel lainyang dapat menyebabkan terjadinya daya hantar listrik.
Kelemahan Teori atom Dalton: tidak dapat menerangkan suatu larutan dapat menghantarkan listrik. Bagaimana mungkin suatu bola pejal dapat menghantarkan listrik, padahal listrik adalah elektron yang bergerak. Berarti ada partikel lainyang dapat menyebabkan terjadinya daya hantar listrik.
2. Model atom Thompson
 |
| model atom Thompson : membuktikan adanya partikel lain dalam atom yaitu elektron yang bermuatan negatif , sehingga atom bukan partikel terkecil lagi |
Kelemahan dari Dalton diperbaiki oleh JJ. Thomson,eksperimen yang dilakukannya tabung sinar katoda. Hasil eksperimennya menyatakan ada partikel bermuatan negatif dalam atom yang disebut elektron.Thomson mengusulkan model atom seperti roti kismis
atau kue onde-onde. Suatu bola pejal yang permukaannya dikelilingi elektron dan partikel lain yang bermuatan positif sehingga atom bersifat netral.
Kelebihan
model atom Thompson :
membuktikan adanya partikel lain dalam atom yaitu elektron yang bermuatan
negatif , sehingga atom bukan partikel terkecil lagi
Kelemahan model atom Thompson : belum dapat menerangkan bagaimana susunan muatan positif dalam bola dan jumlah elektron
Kelemahan model atom Thompson : belum dapat menerangkan bagaimana susunan muatan positif dalam bola dan jumlah elektron
3. Model Atom Rutherford
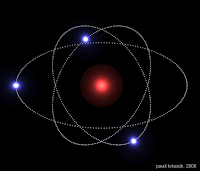 |
| model atom Rutherford :Membuat hipotesa bahwa atom tersusun dari inti atom dan elektron yang mengelilingi inti |
Eksperimen yang dilakukan Rutherford adalah penembakan lempeng tipis dengan partikel alpha. Ternyata partikel itu ada yang diteruskan, dibelokkan atau dipantulkan. Berarti di dalam atom terdapat susunan-susunan partikel bermuatan positif dan negatif.
Hipotesa dari Rutherford adalah :
- Atom terdiri dari inti atom yang sangat kecil dengan muatan positif yang massanya merupakan massa atom tersebut
- Elektron-elektron dalam atom bergerak mengelilingi inti tersebut
- Banyaknya elektron dalam atom sama dengan banyaknya proton di dalam inti dengan nomor atomnya.
Kelebihan
dari model atom ini :Membuat
hipotesa bahwa atom tersusun dari inti atom dan elektron yang mengelilingi inti
Kelemahan dari Rutherford tidak dapat menjelaskan mengapa elektron tidak jatuh ke dalam inti atom. Berdasarkan teori fisika, gerakan elektron mengitari inti ini disertai pemancaran energi sehingga lama - kelamaan energi elektron akan berkurang dan lintasannya makin
lama akan mendekati inti dan jatuh ke dalam inti
4. Model Atom Niels Borh
Kelemahan dari Rutherford tidak dapat menjelaskan mengapa elektron tidak jatuh ke dalam inti atom. Berdasarkan teori fisika, gerakan elektron mengitari inti ini disertai pemancaran energi sehingga lama - kelamaan energi elektron akan berkurang dan lintasannya makin
lama akan mendekati inti dan jatuh ke dalam inti
4. Model Atom Niels Borh
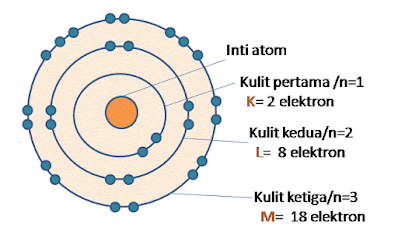 |
| Model atom Bohr adalah bahwa atom terdiri dari beberapa kulit untuk tempat berpindahnya elektron |
Kelemahan dari Rutherford diperbaiki oleh Niels Bohr denganpercobaannya menganalisa spektrum warna dari atom hidrogen yang berbentuk garis.
Hipotesis Bohr adalah:
- Atom terdiri dari inti yang bermuatan positif dan dikelilingi oleh elektron yang bermuatan negatif di dalam suatu lintasan.
- Elektron dapat berpindah dari satu lintasan ke yang laindengan menyerap atau memancarkan energi sehingga energi elektron atom itu tidak akan berkurang.Jika berpindah lintasan ke lintasan yang lebih tinggi maka elektron akan menyerap energi.Jika beralih ke lintasan yang lebih rendah maka akan memancarkan energi.
Kelebihan atom Bohr adalah
bahwa atom terdiri dari beberapa kulit untuk tempat berpindahnya elektron.
Kelemahan
model atom ini adalah: tidak dapat menjelaskan spekrum warna dari atom berelektron banyak.
Sehingga diperlukan model atom yang lebih sempurna
dari model atom Bohr.
dari model atom Bohr.





