|
| Mekanisme Konfigurasi Elektron |
Konfigurasi elektron ialah susunan pengisian dan penyebaran elektron
bagian dalam. Dalam sebuah atom terdapat molekul subatomik proton dan neutron
yang berada di inti atom. Kemudian elektron akan mengelilingi inti atom pada
level atau kulit elektron tertentu.
Jalur penyebaran elektron tersebut dinakaman kulit elektron. Kulit yang
paling dekat dengan inti atom atau kulit pertama dinamakan kulit K. Untuk kulit
keduanya bernama kulit L, kulit ketiga bernama kulit M dan seterusnya secara
urut dalam alfabet hingga kulit tersebut menjauh dengan inti atom.
Kulit kulit elektron juga dapat dijelaskan menggunakan bilangan kuantun
utama (n). Untuk kulit K disebut 1, kulit L disebut 2, dan seterusnya.
Dalam konfigurasi elektron, nilai n yang semakin besar akan mengakibatkan
kulit elektron semakin jauh dari inti atom serta energi elektron akan membesar
pada kulit yang terkait. Elektron tersebut akan mengisi bagian kulit pada atom,
berawal dari kulit K yang memiliki tingkat energi paling rendah.
Kulit elektron hanya dapat di isi oleh beberapa jumlah elektron saja.
Jumlah maksimal elektron yang yapat mengisi bagian kulit elektron ke n ialah
2n2. Tetapi untuk jumlah maksimal pada bagian kulit elektron terluar dalam atom
ialah 8.
Konfigurasi elektron dalam unsur atom yang transisi, penentuannya tidak
menggunakan metode berdasarkan kulit elektron pada atom golongan utama.
Penentuan tersebut berdasaran orbital atom. Untuk setiap orbital atom akan
dipaparkan melalui satu set bilangan pada kuantum magnetik (m), kuantum utama
(n), dan kuantum azimuth (l) yang khusus. Kemudian setiap orbital akan diisi
dengan jumlah maksimal 2 elektron yang mempunyai bilangan spin (s). Keempat
jenis bilangan kuantum tadi berguna untuk mendiskripsikan energi dalam
elektron. Berikut penjelasan selengkapnya :
Bilangan kuantun utama (n) dalam konfigurasi elektron menggambarkan
tingkat dan ukuran dari energi orbital. Dimana nilai n boleh memiliki bilangan
bulat yang positif.
Bilangan kuantum azimuth (l) dalam konfigurasi elektron menggambarkan
bentuk orbitalnya. Dimana l boleh memiliki bilangan bulat mulai dari 0 sampai
n-1.
Bilangan kuantum magnetik (m) dalam konfigurasi elektron menggambarkan
orientasi orbital. Dimana nilai m boleh memiliki bilangan mulai dari -1 sampai
+1.
Bilangan kuantum spin (s) dalam konfigurasi elektron menggambarkan arah
dari spin elektron orbital. Dimana nilai s boleh memiliki bilangan +1/2 atau
-1/2.
Namun sebelum memahami lebih lanjut mengenai konfigurasi elektron,
terlebih dahulu kita pahami teori atom dan mekanika kuantum. Serta apa itu
orbital?.
Orbital
Orbital adalah daerah
yang terletak di sekitar inti atom dimana merupakan kemungkinan terbesar
elektron bisa ditemukan. Terdapat banyak orbital di dalam atom yang
masing-masing memiliki ukuran, bentuk, maupun arah orientasi yang berbeda dan
ditentukan oleh bilangan kuantum. Semua orbital tersebut tergabung menjadi satu
membentuk subkulit. Subkulit juga bergabung menjadi kulit.
alam pembahasan kali
ini kita akan mengenal kulit s, p, d, dan f. Subkulit s tersusun atas
orbital-orbital dengan bilangan kuantum l=0. Subkulit p tersusun atas 3 orbital
yaitu px, py, dan pz serta bilangan kuantum l = 1. Subkulit d tersusun dari 5
orbital yaitu dxy, dyz, dxz, dx2-y2, dan dz2.
Aturan Konfigurasi
Elektron
Setiap atom memiliki
konfigurasi yang khas atau tertentu. sebagai contoh, jika terdapat atom Natrium
di subkulit 1s, dan terdapat atom Magnesium di subkulit yang sama, namun tingat
energinya berbeda. aturan-aturan umum di bawah ini akan membantu memperkirakan
penataan elektron suatu atom.
1. Aturan Aufbau
Dalam prinsi Aufbau,
elektron akan stabil jika berada di tingkat energi yang lebih rendah. Dengan
kata lain, elektron suatu atom cederung menempati subkulit yang mempunyai
tingkat energi lebih rendah. Bagaimana mengetahui besarnya tingkat energi
subkulit?
Caranya adalah dengan
mengetaui nilai bilangan kuantum utama atau n serta bilangan kuantum azimut
atau l. semakin besar nilai (n+l) maka semakin besar nilai tingkat energi suatu
orbital. Urutan energi orbital dari yang paling renda ke yang lebih tinggi
adalah sebagai berikut.
2. Larangan Pauli
Larangan Pauli
disebut juga Eksklusi Pauli. Dalam larangan tersebut dinyatakan bahwa
elektron-elektron di dalam satu atom tidak boleh atau tidak bisa memiliki nilai
bilangan kuantum yang sama. Nilai n, l, dan m bisa jadi sama namun nilai
bilangan kuantum spin (s) harus berbeda karena dalam orbital hanya boleh
terdapat dua elektron yang memiliki spin atau arah putar yang berlawanan.
Larangan Pauli juga
menyebutkan bahwa di dalam subkulit s hanya ada 1 orbital dengan jumlah
maksimum elektron yaitu 2. Di dalam subkulit p, terdapat 3 orbital dan jumlah
maksimum elektronnya adalah 6. Subkulit d memiliki 5 orbital dengan jumlah
maksimum elektron yaitu 10. Sedangkan orbital f memiliki jumlah orbital
sebanyak 7 dengan jumlah maksimum elektron yaitu 14.
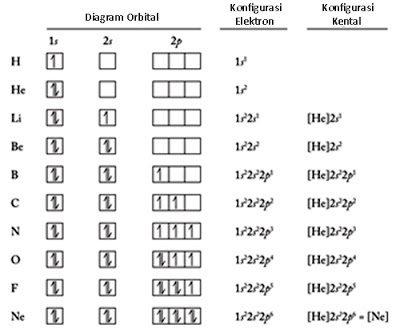
3. Aturan Hund
Dalam suatu atom yang
memiliki jumlah elektron lebih dari satu, elektron-elektron tersebut akan
menyebar dan menempati orbital-orbital sesuai tingkat energi. Dalam aturan Hund
menyatakan bahwa elektron-elektron tersebut tersebar ke seluruh orbital yang
memiliki spin yang sama atau sejajar. Dengan begitu elektron akan lebih stabil
daripada menyebar secara acak.
Selain itu juga
terdapat beberapa penyimpangan yang bisa terjadi pada suatu elektron di dalam
atom. Penyimpangan pertama terjadi pada atom-atom yang berasal gari golongan
transisi. Elektron-elektron cenderung menempati orbital secara penuh atau
setengah penuh untuk mencapai kestabilan.
Elektron juga dapat
tereksitasi, atau berpindah ke tingkat energi yang lebih tinggi. Sehingga
menghasilkan konfigurasi elektron yang berbeda dari konfigurasi sebelumnya yang
lebih stabil. Peristiwa eksitasi ini terjadi misalnya ketika suatu atom akan
berikatan dengan atom lain.
Referensi :
Brady, James E. 1990.
General Chemistry, (Principles & Structures). New York: John Wiley and
Sons.
Chang, R. 2005.
Chemistry. 8th ed. New York: Mc-Graw Hill.
Keenan, Charles E.
et. al, – Pudjaatmaka. 1999. Ilmu Kimia Universitas (terjemahan). Jakarta:
Erlangga.
https://www.siswapedia.com/konfigurasi-elektron/
http://materi4belajar.blogspot.com/2017/12/penjelasan-konfigurasi-elektron-lengkap_13.html
https://dosenpintar.co.id/konfigurasi-elektron/