|
| Yang Penasaran Sama Ikatan Hidrogen Silakan Dipelajari |
Ikatan hidrogen adalah gaya tarik antar-molekul yang terjadi antara atom
hidrogen yang terikat dengan atom sangat elektronegatif (N, O, atau F) dan
pasangan elektron bebas dari atom sangat elektronegatif lainnya. Ikatan ini
muncul sebagaimana ikatan N—H, O—H, dan F—H bersifat sangat polar, di mana
muatan parsial positif pada H dan muatan parsial negatif pada atom
elektronegatif (N, O, atau F).
Sebagai contoh,
ikatan hidrogen terdapat pada antar molekul H2O dan antar molekul NH3, seperti
yang ditunjukkan dalam gambar berikut. Ikatan hidrogen sebenarnya merupakan
gaya dipol-dipol yang terjadi antara molekul-molekul polar. Namun, ikatan ini
dibedakan secara khusus karena kekuatan gaya interaksinya relatif lebih kuat
dibanding gaya dipol-dipol umumnya. Hal ini dikarenakan atom hidrogen tidak
memiliki elektron inti yang dapat melindungi (shielding) inti atom dan
ukurannya cukup kecil sehingga dapat lebih didekati oleh molekul-molekul lain
dan jarak antara hidrogen dan muatan parsial negatif pasangan elektron bebas
menjadi sangat dekat. Akibatnya, energi interaksi dipol-dipol antara hidrogen
dan pasangan elektron bebas pada atom elektronegatif menjadi lebih besar dari
energi interaksi dipol-dipol lainnya.
Secara umum,
ikatan hidrogen digambarkan sebagai X—H···Y—, di mana X dan Y melambangkan atom
sangat elektronegatif (N, O, atau F) dan tiga titik (···) melambangkan ikatan
hidrogen. Fragmen X—H biasanya dikenal sebagai donor ikatan hidrogen
sebagaimana fragmen X—H memiliki hidrogen yang menjadi bagian dari ikatan
hidrogen. Sedangkan, fragmen Y— dikenal sebagai akseptor sebagaimana Y adalah
atom elektronegatif dengan pasangan elektron bebas penerima hidrogen yang
menjadi bagian dari ikatan hidrogen.
Ikatan Hidrogen dan Sifat Fisis
Sifat fisis
seperti titik lebur dan titik didih sangat dipengaruhi oleh gaya interaksi
antar-molekul. Adanya ikatan hidrogen sebagai gaya interaksi antar-molekul yang
paling kuat memberikan pengaruh yang signifikan pada titik didih beberapa
senyawa hidrida biner dari unsur-unsur golongan IVA hingga VIIA. Berikut grafik
yang menunjukkan titik didih dari senyawa-senyawa biner hidrogen dan unsur
golongan IVA hingga VIIA. Titik didih dari senyawa hidrida unsur golongan IVA
(CH4, SiH4, GeH4, dan SnH4, seluruhnya nonpolar) meningkat dari atas ke bawah
golongan (dari C ke Sn). Hal ini dapat dimengerti sebagai akibat dari adanya
polarisabilitas dan gaya dispersi London secara umum meningkat seiring dengan
bertambahnya massa molekul. Senyawa-senyawa hidrida dari golongan VA, VIA, dan
VIIA secara umum juga mengikuti pola kenaikan titik didih yang sama, namun
khusus untuk senyawa NH3, H2O, dan HF titik didihnya jauh lebih tinggi dari
yang diperkirakan.
Faktanya, ketiga
senyawa ini juga memiliki sifat-sifat yang membedakannya dari senyawa-senyawa
lain dengan massa molekul dan polaritas yang bermiripan. Sebagai contoh, air
(H2O) memiliki titik leleh yang tinggi, kalor jenis yang tinggi, dan kalor
penguapan yang tinggi. Sifat-sifat ini menunjukkan bahwa adanya gaya
antar-molekul tak lazim yang kuat pada molekul-molekul ketiga senyawa tersebut,
yakni ikatan hidrogen.
Ikatan
Hidrogen pada Air
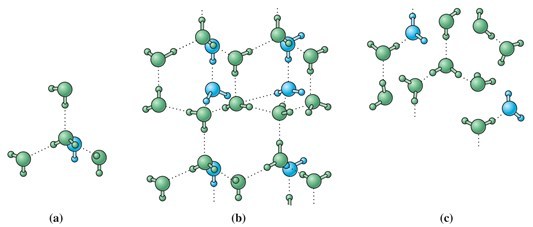
Pada air, satu
molekul air dapat berikatan hidrogen dengan empat molekul air lain di
sekitarnya dalam susunan tetrahedral seperti terlihat dalam gambar (a) di
bawah. Pada es, molekul-molekul air berikatan hidrogen dalam struktur susunan
yang kaku namun lebih terbuka. Struktur yang lebih terbuka (berongga) pada es
seperti terlihat pada gambar (b) mengakibatkan es memiliki densitas (massa
jenis) yang lebih kecil. Ketika es melebur, sebagian ikatan hidrogen putus. Hal
ini menyebabkan molekul-molekul air dapat tersusun lebih rapat sehingga
densitasnya meningkat seperti terlihat pada gambar (c). Dengan kata lain,
jumlah molekul H2O per satuan volum dalam wujud cair lebih banyak dibanding
dalam wujud padat. Seiring air es dipanaskan di atas titik lebur, pemutusan
ikatan hidrogen terus berlanjut sehingga molekul-molekul air menjadi semakin
tersusun rapat dan densitas air semakin meningkat. Air dalam wujud cair akan
mencapai densitas maksimum pada suhu 3,98°C. Di atas suhu tersebut, air berperilaku
“normal” seperti zat-zat lain pada umumnya sebagaimana densitas menurun seiring
dengan kenaikan suhu.
Sifat anomali air
ini berperan dalam beberapa fenomena-fenomena yang terjadi di bumi, seperti
misalnya gunung es yang mengapung di atas perairan dan meledaknya pipa air pada
musim salju. Ledakan pipa air dapat terjadi jika pendinginan terjadi secara
mendadak sebagaimana air yang membeku menjadi es mengalami pemuaian. Dalam
peristiwa es yang mengapung pada perairan yang membeku di musim salju, mengapungnya
bongkahan es akan menghambat terjadinya pembekuan air lebih lanjut sehingga
makhluk hidup yang berada di dalam perairan dapat bertahan hidup. Tanpa adanya
sifat anomali air oleh karena keberadaan ikatan hidrogen ini, perairan akan
membeku dari dasar hingga ke permukaan. Hal ini tentunya akan mengakibatkan
makhluk hidup di perairan tersebut terancam tidak dapat bertahan hidup selama
musim salju.
Ikatan
Hidrogen pada Makhluk Hidup
Reaksi-reaksi
kimia pada tubuh makhluk hidup melibatkan senyawa-senyawa dengan struktur
kompleks, seperti protein dan DNA, di mana dalam reaksi-reaksi tersebut
ikatan-ikatan tertentu harus dapat dengan mudah diputuskan dan dibentuk
kembali. Ikatan hidrogen merupakan ikatan yang energinya pas dalam memungkinkan
hal tersebut. Energi ikatan hidrogen paling besar di antara gaya-gaya interaksi
antar-molekul lainnya, dan energinya relatif jauh lebih kecil dibanding ikatan
kimia intramolekul seperti ikatan kovalen dan ikatan ionik.
Bentuk dari suatu
molekul protein sangat dipengaruhi oleh ikatan hidrogen; jika ada ikatan-ikatan
yang putus, molekul protein dapat kehilangan fungsinya. Ikatan ini juga
berperan penting dalam mengikatkan kedua untai molekul DNA membentuk heliks
ganda. Ikatan hidrogen yang tidak terlalu kuat ini dapat mempertahankan
struktur rantai ganda DNA namun juga dapat dengan mudah diputuskan pada proses
replikasi DNA dalam pembelahan sel.