Belajar Kimia-Setiap senyawa kimia tentunya memiliki nama spesifik untuk membedakannya dari senyawa yang lain. Untuk memudahkan pengenalan nama dan mencegah kesimpangsiuran dalam memberi nama senyawa kimia, IUPAC (International Union of Pure and Applied Chemistry) membuat suatu aturan penamaan. Aturan IUPAC dalam penamaan senyawa kimia dibedakan untuk senyawa anorganik dan senyawa organ
Tata Nama Senyawa Anorganik
Tata nama senyawa anorganik dapat dikelompokkan menjadi senyawa ion, senyawa molekul, dan asam.
a. Senyawa ion
Senyawa ion terdiri dari kation (ion positif) dan anion (ion negatif). Pada umumnya, kation merupakan ion logam dan anion merupakan ion nonlogam.
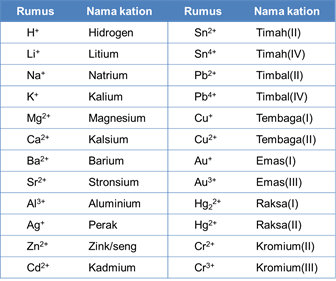
Kation
1. Kation dari unsur logam diberi nama sama dengan unsur logam tersebut.
Contoh: ion natrium (Na+), ion kalsium (Ca2+), ion perak (Ag+)
2. Jika logam dapat membentuk kation dengan muatan berbeda, jumlah muatannya ditulis dengan angka Romawi dalam tanda kurung setelah nama unsur logam itu.
Contoh: ion besi(II) (Fe2+), ion besi(III) (Fe3+)
3. Kation dari unsur nonlogam umumnya memiliki akhiran -ium.
Contoh: ion amonium (NH4+), ion hidronium (H3O+)
Anion
- Anion monoatom diberi nama dengan akhiran -ida pada nama unsur tersebut.
Contoh: ion hidrida (H−), ion oksida (O2−), ion nitrida (N3−), ion fluorida (F−)
- Anion poliatom yang mengandung unsur oksigen (oksoanion) diberi nama dengan akhiran -at ataupun -it. Akhiran -at digunakan untuk anion poliatom yang memiliki atom O lebih banyak dibanding anion dengan akhiran -it.
Contoh: ion nitrat (NO3−), ion nitrit (NO2−). ion sulfat (SO42−), ion sulfit (SO32−)
- Anion yang diturunkan dari penambahan H+ pada oksoanion diberi nama dengan menambahkan awalan hidrogen atau dihidrogen.
Contoh: ion hidrogen karbonat (HCO3−), ion dihidrogen fosfat (H2PO4−)
Nama senyawa ion terdiri dari nama kation di awal kemudian diikuti dengan nama anion di akhir.
Contoh:
KBr
: kalium bromida
BaCl2
: barium klorida
Ag2S
: perak sulfida
Al(NO3)3 : aluminium
nitrat
FeS
: besi(II) sulfida
Fe2O3
: besi(III) oksida
CuSO4
: tembaga(II) sulfat
NH4CN : amonium
sianida
b. Senyawa molekul
Senyawa molekul terdiri unsur-unsur nonlogam. Pada bagian ini, tata nama senyawa molekul yang akan dibahas hanya untuk senyawa molekul biner, yaitu senyawa molekul yang hanya terdiri dari dua jenis unsur. Berikut aturan penamaaan senyawa molekul biner.
1. Nama dari unsur yang terletak lebih kiri pada sistem periodik unsur ditulis terlebih dahulu sebagai unsur pertama. Pengecualian untuk senyawa yang mengandung oksigen, dan klorin, bromin, atau iodin (semua halogen kecuali fluorin), oksigen ditulis sebagai unsur terakhir.
Contoh: HBr, BCl3, PCl5, CS2, NO, Cl2O, I2O5, OF2
2. Jika kedua unsur berada pada golongan yang sama, maka unsur pertama adalah unsur yang terletak lebih bawah pada golongan dalam sistem periodik unsur.
Contoh: ClF3, IF5
3. Unsur terakhir diberi akhiran -ida.
Contoh: HF (hidrogen fluorida), H2S (hidrogen sulfida)
4. Jumlah atom dari masing-masing unsur menentukan awalan bahasan Yunani yang dipakai untuk penulisan nama senyawa molekul. Awalan -mono tidak digunakan untuk unsur pertama.
Contoh: N2O (dinitrogen monoksida), N2O5 (dinitrogen pentaoksida), NO2 (nitrogen dioksida), CO (karbon monoksida), CS2 (karbon disulfida), PCl5 (fosforus pentaklorida), SF6 (sulfur tetrafluorida), IBr (iodin monobromida).
c. Asam
Berdasarkan definisi asam basa oleh Arrhenius, senyawa asam adalah senyawa yang bila dilarutkan dalam air akan melepas ion H+. Pada umumnya, asam dapat terionisasi dalam air menjadi ion H+ dan anion yang disebut sisa asam. Penamaan senyawa asam dimulai dari kata ‘asam’ diikuti dengan nama anion sisa asam.
Contoh:
HCl
: asam klorida
HF : asam fluorida
H2S : asam sulfida
HCN : asam sianida
H2CO3 : asam karbonat
H2SO4 : asam sulfat
HClO4 : asam perklorat
Tatanama Senyawa Koordinasi
Untuk memberikan nama senyawa kompleks diperlukan beberapa aturan tertentu yang perlu diperhatikan sebagai berikut:
1. Nama kation disebutkan terlebih dahulu daripada nama anionnya.
2. Untuk ion kompleks yang bermuatan positif, nama ligan disebutkan terlebih dahulu dan selanjutnya diikuti nama ion pusatnya
3. Untuk menyatakan banyaknya ligan sederhana dipakai awalan di untuk 2 ligan sejenis, tri untuk 3 ligan, tetra untuk 4 ligan, penta untuk 5 ligan, heksa untuk 6 ligan dan seterusnya. Untuk menyatakan banyaknya ligan yang kompleks (misalnya ligan organik) dipakai awalan bis untuk 2 ligan, tris untuk 3 ligan, tetrakis untuk 4 ligan, pentakis untuk 5 ligan, heksakis untuk 6 ligan dan seterusnya.
4. Jika ligan lebih dari satu macam, penyebutan nama ligan diurut sesuai dengan urutan alfabetik.
5. Nama ligan negatif (ligan anion) diakhiri dengan huruf–o dari nama asli kelompoknya, misalnya fluoro, kloro, siano, karbonato, tiosulfato, oksalato dan sebagainya, sedangkan ligan netral susuai nama molekulnya kecuali ligan-ligan khusus seperti H2O = aqua; NH3 = amina; CO = karbonil; NO = nitrosil.
6. Nama
ion pusat selalu diikuti oleh tingkat oksidasi ion pusat tersebut. Jika ion kompleks
berupa anion, nama atom pusat sesuai dengan nama latinnya dan diberi akhiran –at,
tetapi jika ion kompleks berupa kation atau kompleks netral, maka nama ion
pusat sama dengan nama unsurnya.
Beberapa contoh nama senyawa koordinasi atau ion kompleks adalah sebagai berikut:
K4[Fe(CN)6] : kalium heksasianoferat (II)
[Cu(NH3)4]2+ : ion tetraaminatembaga (II)
Na3[Cr(NO2)6] : natrium heksanitritokromat (III)
[Co(en)3]Cl3 : tris(etilinadiamina)kobal (III) klorida